 计划肿瘤靶区体积(planning target volume,PTV)包括治疗前原发肿瘤,转移淋巴结区域并外扩1 cm边界。绝大多数患者接受了50~60 Gy的化疗,单次剂量为2 Gy。
计划肿瘤靶区体积(planning target volume,PTV)包括治疗前原发肿瘤,转移淋巴结区域并外扩1 cm边界。绝大多数患者接受了50~60 Gy的化疗,单次剂量为2 Gy。
1.3 观察指标及方法
观察指标包括性别、年龄、卡氏功能状态(KPS)评分、吸烟史、放化疗模式、预防性脑照射(prophylactic cranial irradiation,PCI)、化疗周期数等。治疗结束后前2年内每3个月进行1次随访,之后3年,每半年进行1次随访。随访内容包括临床症状和胸腹部CT,当患者出现相关症状时行颅脑磁共振、全身骨显像检查。将总生存(OS)作为主要研究终点,其定义为患者首次诊断至死亡或失访时间。
近期疗效为治疗中和治疗后1个月内的最佳疗效,具体疗效评定标准:根据2009年实体瘤疗效评价标准(RECIST)[9],疗效评价分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。CR+PR为治疗有效,SD+PD为治疗无效。
1.4 统计学方法
采用SPSS 19.0对所得数据进行统计学分析,计数资料采用百分率表示,组间比较采用χ2检验。应用Kaplan-Meier方法绘制生存曲线并应用Log-rank对比不同分组组间患者生存差异,单因素分析中P < 0.10的进入COX回归多因素生存分析。所有检验均为双边模式,以P < 0.05为差异有统计学意义。
2 结果
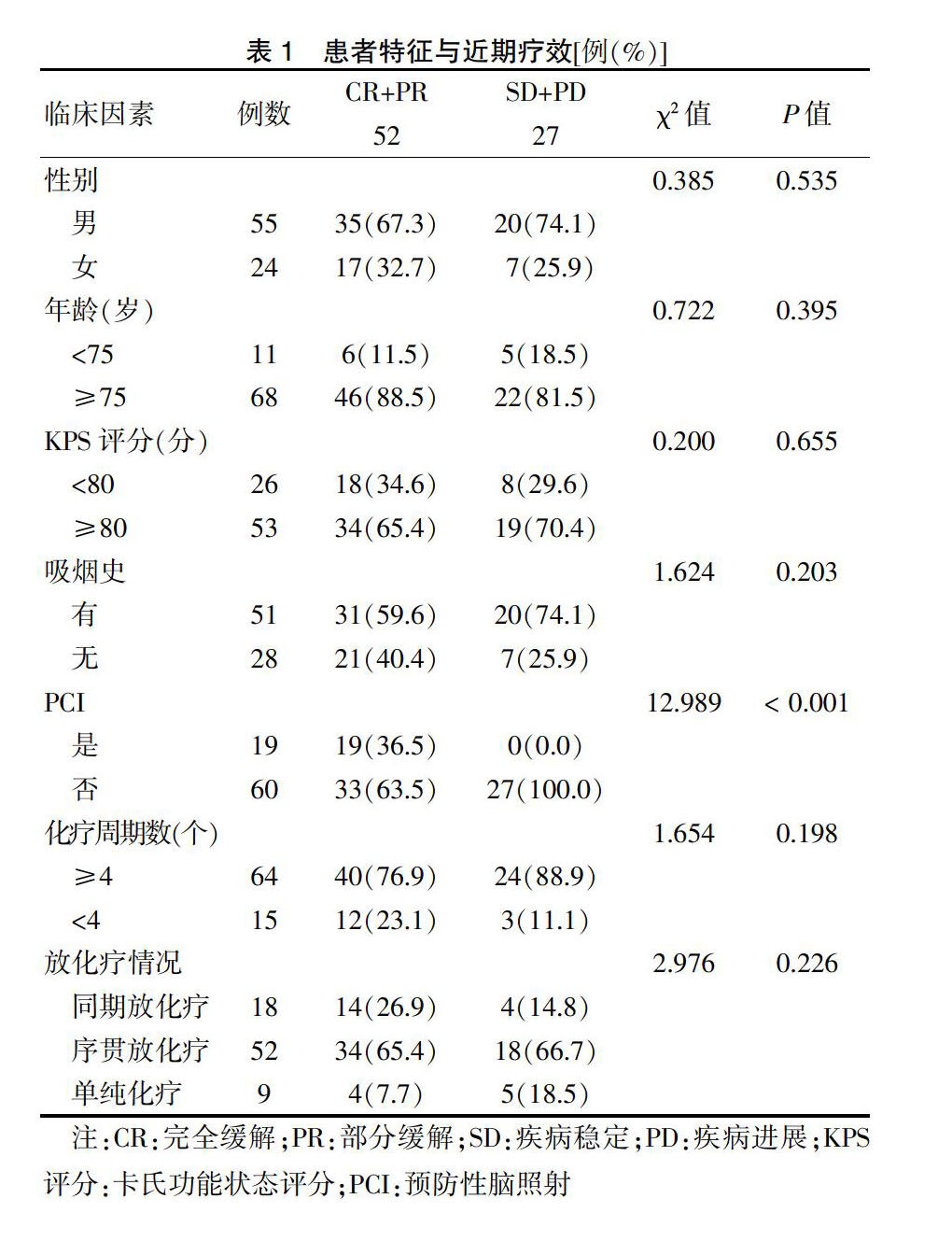
2.1 患者特征与近期疗效
79例患者中,疗效评价为有效的为52例,占比为65.8%,无效为27例,占比为34.2%。临床特征中,行PCI治疗者的疗效评价均为有效。未发现其余临床特征与疗效明显相关。见表1。
2.2 单因素及多因素生存分析
随访至2019年1月,随访时间为5~75个月,中位随访时间为16个月。79例患者的中位生存期为15.4个月,2年生存率为25.6%。不同性别、年龄、KPS评分、吸烟史、治疗模式等组间生存比较,提示KPS评分、PCI与放疗与化疗联合为预后因素(P < 0.05),而年龄和化疗周期数与患者生存具有边缘相关性(0.05 < P < 0.01)。见表2。以上因素进行多因素生存分析,结果提示KPS评分、PCI、放疗与化疗联合治疗(同期放化疗与序贯放化疗)和化疗周期数为独立的预后因素(P < 0.05)。见表3,生存曲线见图1。
3 讨论
随着人均寿命的不断延长,老年肿瘤患者的比例逐渐增加。目前,老年肿瘤患者这一群體也因为其特殊性而越来越受到社会和医学界关注。所谓特殊性主要是指老年患者身体机能的衰退,合并症多,对于较高强度的标准治疗的耐受性差等。这一情况也体现于SCLC患者,特别是标准治疗为较高强度的同期放化疗的局限期SCLC患者。理论上同期放化疗对于老年SCLC患者同样有效,但是治疗是否能够耐受是个需要考量的问题。在一个Ⅱ期临床实验中,接受高剂量放疗联合同期顺铂和依托泊苷化疗的患者中80%出现了4级以上的毒性反应[10]。因此,谨慎的选择治疗方案是非常有必要的,而预后相关的因素可以起到指导和优化作用。在本研究中通过单因素和多因素生存分析,确立了KPS评分、PCI、放疗与化疗联合治疗和化疗周期数为独立的预后因素。
本研究首先觀察了患者特征与近期疗效之间的关系,仅发现PCI与近期疗效密切相关,这与PCI的选择标准相关,因为只有CR或PR的患者才考虑行PCI治疗[11]。其他因素并未被发现与近期疗效相关,推测原因可能是本研究样本量较少所致。体力状态评分是肿瘤科医生进行治疗方案选择时需要考虑的最重要指标之一。对于体力状态好的患者,往往会给予较规范的高强度治疗,患者也往往会从治疗中获益。本研究结果提示KPS评分是局限期老年SCLC患者的独立预后因素。这一结果同样被多项研究证实[5,12]。SCLC患者脑转移的发生率很高,最终约75%的患者会出现脑转移的情况,前瞻性研究提示PCI可以降低一半的脑转移发生率,同时将患者的3年总生存率提升5%[13]。对于获得PR和CR的局限期SCLC患者来说,PCI是标准治疗方案中的一部分。在本研究中,PCI也被发现与患者的生存明显相关,是独立的预后因素。这与多个前瞻性研究的结果是一致的[5,11]。
一个关于老年SCLC患者的回顾性研究发现广泛期和不足4周期化疗是独立的不良预后因素[14]。本研究的研究对象为局限期的老年SCLC患者,同样发现接受不足4周期化疗的患者的生存期较接受4周期及以上化疗者短。推测接受少于4周期化疗者多数是因为体力状态、毒性反应、并发症的情况导致了化疗强度不够,进而影响了肿瘤的控制。另一个重要的治疗相关因素为放疗和化疗的结合。在本研究中,同期放化疗和序贯放化疗均优于单纯化疗,同时同期放化疗优于序贯放化疗。这一结果与确立同期放化疗地位的Ⅲ期临床研究相一致[15-17]。这提示,在没有禁忌证的情况下,为老年SCLC患者行放化联合特别是放化同期治疗是能够为带来生存获益的。
靶向治疗一直是肺癌领域的研究热点,然而在SCLC的治疗中,绝大多数研究都没有得到阳性结果,这包括贝伐珠单抗、舒尼替尼、阿柏西普等多种抗血管生成的靶向药物[18]。近2年,免疫治疗的发展迅速,免疫调定点抑制剂通过抑制肿瘤细胞免疫逃逸而起到控制肿瘤的作用[19]。在近期的两个临床研究中,Nivolumab联合Ipilimumab和Pembrolizumab等免疫治疗方案均显示出了一定效果,因此被作为二线治疗方案之一在NCCN指南中推荐[20-21]。因为本研究为回顾性研究,并未有患者应用免疫治疗,但可以推测未来免疫治疗很可能在老年局限期小细胞肺癌中占有一席之地。
总之,在本研究中,单因素和多因素生存分析显示KPS评分、PCI、放疗与化疗联合治疗和化疗周期数为独立的预后因素。这提示在临床工作中,在患者可耐受的前提下,选择规范的较高强度治疗方案同样可以为老年局限期SCLC患者带来生存的获益。
[参考文献]
[1] Oronsky B,Reid TR,Oronsky A,et al. What′s new in sclc? A review [J]. Neoplasia,2017,19(10):842-847.
[2] 肖家雯,孙素华.吉西他滨单药治疗老年晚期非小细胞肺癌的临床观察[J].中国医药导报,2009(13):99-100.
[3] Roengvoraphoj O,Eze C,Niyazi M,et al. Prognostic role of patient gender in limited-disease small-cell lung cancer treated with chemoradiotherapy [J]. Strahlenther Onkol,2017,193(2):150-155.
[4] Sun A,Durocher-Allen LD,Ellis PM,et al. Initial management of small-cell lung cancer (limited- and extensive-stage) and the role of thoracic radiotherapy and first-line chemotherapy:A systematic review [J]. Curr Oncol,2019,26(3):e372-e384.
[5] Steffens CC,Elender C,Hutzscheeuter U,et al. Treatment and outcome of 432 patients with extensive-stage small cell lung cancer in first,second and third line - results from the prospective german tlk cohort study [J]. Lung Cancer,2019,130:216-225.
[6] Zimmerman S,Das A,Wang S,et al. 2017-2018 scientific advances in thoracic oncology:Small cell lung cancer [J]. J Thorac Oncol,2019,14(5):768-783.
[7] Yang S,Zhang Z Wang Q. Emerging therapies for small cell lung cancer[J]. J Hematol Oncol,2019,12(1):47.
[8] Povsic M,Enstone A,Wyn R,et al. Real-world effectiveness and tolerability of small-cell lung cancer (sclc) treatments: A systematic literature review(slr)[J]. PLoS One,2019,14(7):e0 219 622.
[9] Eisenhauer E A,Therasse P,Bogaerts J,et al. New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J]. Eur J Cancer,2009,45(2):228-247.
[10] Schild SE,Bonner JA,Hillman S,et al. Results of a phase Ⅱ study of high-dose thoracic radiation therapy with concurrent cisplatin and etoposide in limited-stage small-cell lung cancer(ncctg 95-20-53)[J]. J Clin Oncol,2007,25(21):3124-3129.
[11] Tomono H,Honda N,Dotsu Y,et al. Strategies to prevent brain metastasis [J]. Cancer Chemother Pharmacol,2019.
[12] Reymen B,Van Loon J,van Baardwijk A,et al. Total gross tumor volume is an independent prognostic factor in patients treated with selective nodal irradiation for stage Ⅰ to Ⅲ small cell lung cancer [J]. Int J Radiat Oncol Biol Phys,2013,85(5):1319-1324.
[13] Péchoux CL,Sun A,Slotman BJ,et al. Prophylactic cranial irradiation for patients with lung cancer [J]. Lancet Oncol,2016,17(7):e277-e293.
[14] Liu S,Guo H,Kong L,et al. The prognostic factors in the elderly patients with small cell lung cancer: A retrospective analysis from a single cancer institute [J]. Int J Clin Exp Pathol,2015,8(9):11 033-11 041.
[15] Faivre-Finn C,Snee M,Ashcroft L,et al. Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer(convert):An open-label,phase 3,randomised,superiority trial [J]. Lancet Oncol,2017,18(8):1116-1125.
[16] Wang S,Zimmermann S,Parikh K,et al. Current diagnosis and management of small-cell lung cancer [J]. Mayo Clin Proc,2019,94(8):1599-1622.
[17] Levy A,Hendriks LEL,Le Péchoux C,et al. Current management of limited-stage sclc and convert trial impact: Results of the eortc lung cancer group survey [J]. Lung Cancer,2019,136:145-147.
[18] Ready NE,Pang HH,Gu L,et al. Chemotherapy with or without maintenance sunitinib for untreated extensive-stage small-cell lung cancer: A randomized,double-blind,placebo-controlled phase ii study-calgb 30504(alliance)[J]. J Clin Oncol,2015,33(15):1660-1665.
[19] Hsu WH,Zhao X,Zhu J,et al. Checkpoint kinase 1 inhibition enhances cisplatin cytotoxicity and overcomes cisplatin resistance in sclc by promoting mitotic cell death [J]. J Thorac Oncol,2019,14(6):1032-1045.
[20] Sharma P,Siefker-Radtke A,de Braud F,et al. Nivolumab alone and with ipilimumab in previously treated metastatic urothelial carcinoma: Checkmate 032 nivolumab 1 mg/kg plus ipilimumab 3 mg/kg expansion cohort results [J]. J Clin Oncol,2019,37(19):1608-1616.
[21] Ott PA,Bang YJ,Piha-Paul SA,et al. T-cell-inflamed gene-expression profile,programmed death ligand 1 expression,and tumor mutational burden predict efficacy in patients treated with pembrolizumab across 20 cancers:Keynote-028 [J]. J Clin Oncol,2019,37(4):318-327.
(收稿日期:2019-08-27 本文編辑:顾家毓)
