打开文本图片集
摘要:指出了苦杏仁苷作为氰苷类化合物,成为某些药物的有效成分,可治疗哮喘、支气管炎、肺气肿、便秘、麻风病和白斑病等多种疾病。对苦杏仁苷在不同植物中的含量、药理作用、毒性、代谢、检测方法、酶解、提取方法等方面的研究报道进行了综述,并提出了对今后研究的展望。
关键词:苦杏仁苷;药理作用;代谢;酶解;检测;提取
中图分类号:R284.1
文献标识码:A 文章编号:1674-9944(2015)10-0286-03
1 引言
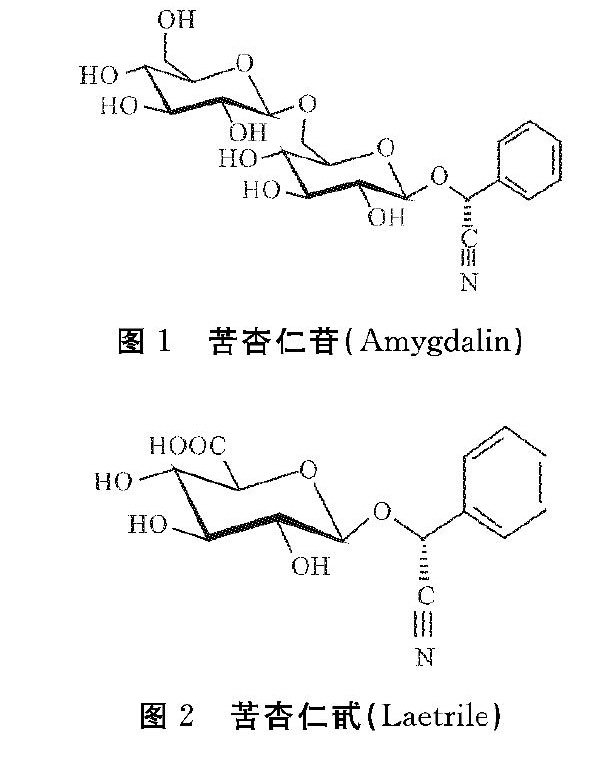
苦杏仁苷(Amygdalin)是在蔷薇科植物种仁中普遍存在的含氰基的糖苷化合物,存在于杏、桃,李子、苹果、山楂、批把等[1,4,14]植物的种仁中。它又称作苦杏仁甙,苯乙醇腈-β-葡糖苷酸,维生素B17,苯乙醇腈。虽然苦杏仁苷和苦杏仁甙(Laetrile)之间存在着结构和异构差别,但是相互等同使用。天然的苦杏仁甙是有活性的右旋物,异构化以后形成没有活性的左旋物[1](图1、图2)。
2 苦杏仁苷在植物中的含量
除了蔷薇科外,它在忍冬科、含羞草科和木犀科植物中也存在,在青梅中含量最高,其次为杏子、黑梅、桃子、红樱桃和黑樱桃、紫梅、黄梅和红梅,油桃的苦杏仁苷含量最小[2]。苦杏仁苷在桃仁中的含量为2.72%~3.13%,在杏仁中含量为3.62%~5.19%,在乌梅中含量为0.23%[3],在苦杏仁中含量一般2%~3%[4]。苦杏仁苷含量直接影响杏仁的苦味程度,随着苦杏仁苷含量增加苦味度也增加。苦杏仁的苦杏仁苷的含量比甜杏仁的苦杏仁苷含量大于1000倍以上[5]。
3 苦杏仁苷的药理作用
50多年以来,苦杏仁苷在欧美洲国家成为非常流行的癌症药物[1]。苦杏仁苷在医药上主要用于祛痰止咳剂、辅助性抗癌药[4]。在日本,桃仁是Oketsu(血瘀综合症治疗药物)的主要成分,并用于很多其他传统药物的成分;活血通路冻干注射粉(HTLPI)(6g包含25.3 mg苦杏仁苷和35.8mg芍药苷)是主要由桃仁和芍药根提取物组成的传统中药药物,主要适用于治疗严重脑出血中风过程中的血瘀阻塞症状[6]。动物实验和细胞实验结果表明苦杏仁苷和其降解物有抗动脉粥样硬化、抗肾间质纤维化、抗肺纤维化、抗高氧诱导肺损伤、免疫抑制、免疫调节、抗肿瘤、抗炎等作用[4]。苦杏仁苷有止咳、镇痛和抗肿瘤作用[3]。在中医,苦杏仁苷应用于治疗哮喘、支气管炎、肺气肿、便秘、麻风病和白斑病等多种疾病[7]。
Chen等人的研究结果显示苦杏仁苷对人宫颈癌细胞有显著的抑制作用,苦杏仁苷可激活细胞凋亡蛋白酶3的活性,抑制Bcl-3蛋白的活性,从而激活内源性细胞凋亡机制[8]。体内实验结果显示苦杏仁苷通过激活细胞凋亡抑制Hela细胞生长[9]。Guo等人的细胞和动物实验结果显示苦杏仁苷可抑制肾脏纤维原细胞(KFB)的增值和转录生长因子(TGF-β1)在淋巴细胞中分泌,从而改善肾脏单侧输尿管梗阻而导致的损害,延迟肾小管间质纤维化的发展[10]。Toll样接受体(TLRs)和TLR信号放大作用在动脉粥样硬化发展过程中有关键作用。苦杏仁苷可降低TLR2和TLR4的mRNA和蛋白质含量,可抑制MyD88依赖信号物质的表达,从而改善ApoE敲出大鼠动脉粥样硬化[11]。Mirmiranpour等人的研究结果显示苦杏仁苷对链脲酶素诱导糖尿病大鼠动脉血管形成有显著抑制作用[12]。
4 代谢
当口服时,苦杏仁苷首先在胃中通过消化酶的酶解分解为野黑樱苷和葡萄糖。野黑樱苷在小肠进一步分解为苯乙醇腈。苯乙醇腈在肠道菌群的作用下成为苯甲醛。苦杏仁苷口服时的LD50为880 mg/kg[13]。
苦杏仁苷静脉注射和口服有不同的代谢机制。苦杏仁苷静脉注射以后在血液里出现高浓度的苦杏仁苷,几乎不会出现氰化物,硫氰酸盐的浓度不会发生变化,注射浓度最高为692.4±173.4 ng/mL[6];然而口服以后血液中的苦杏仁苷的浓度很少,氰化物浓度增加,苦杏仁苷几乎变成野黑樱苷。20 mg/kg的苦杏仁苷口服以后,大鼠血液里出现的苦杏仁苷最高浓度为1 702.52±108.06 ng/mL(1.50±0.08 h)[7]。
5 苦杏仁苷的毒性
苦杏仁苷本身无毒,但通过酶解有可能(β-葡糖苷酶和α-醇腈酶)产生有毒的氰化物。苦杏仁苷和真菌毒素显著影响猪卵巢颗粒细胞的类固醇激素水平。苦杏仁苷或含有苦杏仁苷的物质可能影响卵巢的功能[14]。苦杏仁苷对人的毒性在0.5~3.5 mg/kg。苦杏仁苷中毒表现为头疼、呕吐、恶心、腹绞痛、头晕、身体变虚弱、意识模糊、抽搐、心跳变慢、呼吸衰竭、昏迷,甚至也有可能死亡[13]。
6 酶解
苦杏仁苷作为最常见的生氰苷类化合物,其酶解过程分三个阶段;第一阶段。通过苦杏仁苷裂解酶酶解苦杏仁苷为野黑樱苷和葡萄糖;第二阶段:野黑樱苷裂解酶把野黑樱苷水解为苯乙醇腈和葡萄糖;最后阶段:苯乙醇腈在醇腈酶的作用下水解成苯甲醛和HCN。苦杏仁苷在酸性条件(pH值5.0~5.8)下水解为苯乙醇腈,苯乙醇腈在碱性条件下(pH值10)水解成苯甲醛。苦杏仁苷酶的最适温度为20~40℃,在过高的温度下很容易失活。苦杏仁苷酶水解过程按浸软程度不同需要30 min到6 h的时间[2]。
苦杏仁苷在体外通过黑曲霉分泌酶降解为野黑樱苷、苯甲醛、苯乙醇腈和苯乙腈(37℃)[15]。杏仁碾碎以后酶与苦杏仁苷(AD)接触,并把它降解为葡萄糖、苯甲醛(苦味来源)和氰化氢(有毒)[16]。 7 检测方法
苦杏仁苷检测方法有HPLC和H-1-NMR方法,不过在H-1-NMR检测过程中不需要制备标准样品和制作标准曲线,操作简单,快速[3]。在血液和其他生物液体中的苦杏仁苷检测方法有气相色谱(GC)、高效液相色谱(HPLC)、高效液相色谱质谱联用(HPLC-MS)和液相色谱串联质谱(LC-MS-MS)等方法。苦杏仁苷检测内标准物质(IS)选择京尼平苷为其内标物质是最好的选择[7]。
8 提取方法
除了酶解,苦杏仁苷还在热水中异构化从而降解。D-苦杏仁苷在沸水中加热3 min就变成苦杏仁苷的差位异构体[2]。由于苦杏仁苷特别容易降解,因此合适的提取方法特别重要。合理的提取方法可防止苦杏仁苷的降解。苦杏仁苷提取可用水、甲醇和乙醇。Kool等人通过4%的柠檬酸水来提取杏仁中的苦杏仁苷,防止其异构化并提高提取率。Wei-Feng等人通过比较酸水提取和甲醇提取方法发现0.1%柠檬酸回流提取是最佳提取方法。Bolarinwa等人通过使用水提方法和乙醇提取方法提取巴达木中的苦杏仁苷发现乙醇提取比水提取更有效,并且最佳提取时间为100 min,水最佳提取温度为100℃,乙醇最佳提取温度为78.5℃[2]。在杏仁中除去苦杏仁苷过程中β-葡糖苷酶的降解和苦杏仁苷的洗脱是关键因素。在乙醇浓度为20%和50%时苦杏仁苷洗脱和水解程度达到最大[17]。
9 展望
苦杏仁苷在蔷薇科植物种仁中普遍存在,有止咳、镇痛和抗肿瘤作用,应用于治疗哮喘、支气管炎、肺气肿、便秘、麻风病和白斑病等多种疾病。我国蔷薇科植物资源丰富,但目前对苦杏仁苷的大量开发利用还未实现。今后研究当中,可以利用丰富的资源优势进一步研究并优化其提取及纯化方法,研究抗肿瘤机制,进行药品开发,通过适当处理,让苦杏仁苷参与食品领域。
参考文献:
[1]Milazzo, S., S. Lejeune, E. Ernst, Laetrile for cancer: a systematic review of the clinical evidence[J]. Support Care Cancer, 2007,15(6):583~95.
[2]Bolarinwa, I.F., C. Orfila, M.R.A. Morgan. Amygdalin content of seeds, kernels and food products commercially-available in the UK[J]. Food Chemistry, 2014(152):133~139.
[3]Tanaka, R., A. Nitta, A. Nagatsu. Application of a quantitative H-1-NMR method for the determination of amygdalin in Persicae semen, Armeniacae semen, and Mume fructus[J]. Journal of Natural Medicines, 2014,68(1):225~230.
[4]Lv, J. J. Deng. Research progress in pharmacological effects of amygdalin[J]. Drugs and Clinic, 2012,27(5):530~535.
[5]Sanchez-Perez, R., et al. Influence of the pollinizer in the amygdalin content of almonds[J]. Scientia Horticulturae, 2012(139):62~65.
[6]Li, X., et al. A sensitive LC-MS/MS method for simultaneous determination of amygdalin and paeoniflorin in human plasma and its application[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014(92):160~164.
[7]Li, X.-B., et al. Determination and Pharmacokinetics of Amygdalin in Rats by LC-MS-MS[J]. Journal of chromatographic science, 2014,52(6):476~81.
[8]Chen, J., et al. Metabolic Pharmacokinetics in Rats: Differences between Pure Amygdalin and Amygdalin in a Decoction of Peach Seeds[J]. Bulletin of the Korean Chemical Society, 2012,33(5):1 470~1 474.
[9]Chen, Y., et al. Amygdalin induces apoptosis in human cervical cancer cell line HeLa cells[J]. Immunopharmacology and Immunotoxicology, 2013,35(1):43~51.
[10]Guo, J., et al. Amygdalin inhibits renal fibrosis in chronic kidney disease[J]. Molecular Medicine Reports, 2013,7(5):1 453~1 457.
[11]Zhao, F. Z. Yang. Amygdalin Attenuates Atherosclerosis Progress Through Inhibiting of Toll-Like Receptors Expression and Activity[J]. Journal of Animal and Veterinary Advances, 2012,11(10):1 613~1 621.
[12]Mirmiranpour, H., et al. Amygdalin inhibits angiogenesis in the cultured endothelial cells of diabetic rats[J]. Indian Journal of Pathology and Microbiology, 2012,55(2):211~214.
[13]Perez, J.J. Amygdalin analogs for the treatment of psoriasis[J]. Future Medicinal Chemistry, 2013,5(7):799~808.
[14]Halenar, M., et al. Dose-response of porcine ovarian granulosa cells to amygdalin treatment combined with deoxynivalenol[J]. Journal of Microbiology, Biotechnology and Food Sciences, 2014,3(Special Issue 2):77~79.
[15]Chang, J. Y. Zhang, Catalytic degradation of amygdalin by extracellular enzymes from Aspergillus niger[J]. Process Biochemistry, 2012,47(2):195~200.
[16]Arrazola, G., et al. Content of the cyanogenic glucoside amygdalin in almond seeds related to the bitterness genotype[J]. Agronomia Colombiana, 2012,30(2):260~265.
[17]Yamazaki, S., et al. Reduction of Amygdalin in Apricot Kernels by Immersion in Ethanol Solution[J]. Journal of the Japanese Society for Food Science and Technology, 2012,59(10):522~527.
