 对照品(购于中国药品生物制品检定所,批号:111521-200303),芦丁对照品(购于中国药品生物制品检定所,批号:100080-200306),其余试剂均为分析纯。
对照品(购于中国药品生物制品检定所,批号:111521-200303),芦丁对照品(购于中国药品生物制品检定所,批号:100080-200306),其余试剂均为分析纯。
百华花楸果实采自黑龙江省牡丹江地区,经牡丹江医学院天然药物化学与生药学教研室吴兆华教授鉴定为蔷薇科(Rosaceae)花楸属(Sorbus)百华花楸(Srobus pohuashanensis)干燥成熟的果实。
2 方法与结果
2.1 检测波长的确定
取适当浓度的金丝桃苷与芦丁混合对照品溶液进行紫外扫描,在200~600 nm波长下,金丝桃苷与芦丁在363 nm波长处有较强吸收,并且两峰分离效果较好,故选定检测波长为363 nm。
2.2 色谱条件的确定
色谱柱:Zorbax SB-C18柱(5 μm,4.6 mm×250 mm),流动相:甲醇︰乙腈︰0.025 mol/L磷酸(10∶20∶70),流速为1.0 mL/min,检测波长为363 nm,柱温为30℃。在本色谱条件下,百华花楸果实中芦丁和金丝桃苷的色谱峰与其他成分相邻的色谱峰能够达到很好的分离,理论塔板数按金丝桃苷和芦丁色谱峰计算均不低于5000。结果见图1。
2.3 样品中金丝桃苷和芦丁提取方法的考察
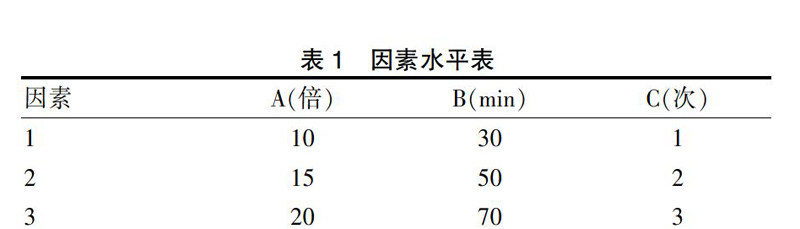
称取百华花楸果实药材9份,每份5 g,以甲醇超声提取,选取溶剂用量(A)、提取时间(B)和提取次数(C)为考察因素,每个因素选取3个水平,因素水平表见表1,选用L9(34)正交试验表安排实验,以金丝桃苷提取率为考察指标,将结果填入正交试验表中,进行直观分析和方差分析[13-15]。由表2、4可知,RC>RA>RB,表明提取率的影响从大到小分别为:提取次数>溶剂用量>提取时间;以芦丁提取率为考察指标,将结果填入正交试验表中,进行直观分析和方差分析。由表3、5可知,RC>RA>RB,表明提取率的影响从大到小分别为:提取次数>溶剂用量>提取时间;通过以上实验结果,结合直观分析、方差分析及实际实验情况,最终确定实验方案为:20倍提取溶剂,超声提取3次,每次30 min。
表1 因素水平表
表2 金丝桃苷提取优化正交试验结果
表3 芦丁提取优化正交试验结果
表4 金丝桃苷含量为指标方差分析
注:*表示显著性
2.4 溶液的制备
2.4.1 对照品溶液的制备 精密称取4.0 mg金丝桃苷对照品,置于25 mL容量瓶中,加入少量甲醇超声溶解并稀释定容至刻度,制成160 μg/mL的金丝桃苷对照品储备液;另精密称取2.5 mg芦丁对照品,置于25 mL容量瓶中,加入少量甲醇超声溶解并稀释定容至刻度,制成100 μg/mL的芦丁对照品储备液;分别精密吸取2 mL芦丁对照品储备液和2 mL金丝桃苷对照品储备液置于10 mL容量瓶中,摇均,甲醇定容至刻度,制成含20 μg/mL芦丁对照品和32 μg/mL金丝桃苷对照品的混合对照品储备液。
2.4.2 样品溶液的制备 称取百华花楸果实药材5 g,置于100 mL容量瓶中,加适量甲醇,超声提取3次,每次30 min,再加甲醇定容至刻度,离心,取上清液经0.45 μm的微孔滤膜过滤,即得。
2.5 线性关系考察
精密吸取金丝桃苷对照品储备液1.0、2.0、4.0、6.0、8.0 mL于10 mL量瓶中,加甲醇稀释至刻度,摇匀,按“2.2”项下条件,进样10 μL,测定峰面积,以峰面积值为纵坐标,对照品量(μg)为横坐标,绘制标准曲线,计算回归方程为:Y=4.08×104X +6.68×103,r = 0.9992,结果表明金丝桃苷在0.16~1.28 μg的范围内呈良好线性关系;另精密吸取芦丁对照品储备液1.0、2.0、4.0、6.0、8.0 mL于10 mL量瓶中,加甲醇稀释至刻度,摇匀,按“2.2”项下条件,进样10 μL,测定峰面积,以峰面积值为纵坐标,对照品量(μg)为横坐标,绘制标准曲线,计算回归方程Y=3.87×104X+5.79×103,r = 0.9994,结果表明芦丁在0.1~0.8 μg的范围内呈良好线性关系。
2.6 精密度试验
精密吸取金丝桃苷和芦丁混合对照品储备液,按“2.2”项下条件,重复进样6次,每次进样量10 μL,记录峰面积,计算日内精密度;连续进样3 d,计算日间精密度。结果表明,日内精密度:金丝桃苷峰面积值的RSD=0.58%,芦丁的RSD=0.76%;日间精密度:金丝桃苷峰面积值的RSD=0.77%,芦丁的RSD=0.87%。以上结果表明仪器精密度较好。
2.7 稳定性试验
取同一份供试品溶液,按“2.2”项下条件,分别于0、1、2、4、8 h分别进样测定,记录金丝桃苷、芦丁组分峰面积。结果金丝桃苷峰面积值的RSD=0.79%;芦丁峰面积值的RSD=0.92%,表明金丝桃苷、芦丁组分在8 h内稳定。
2.8 重复性试验
取百华花楸果实药材5 g,按“2.4.2”项下样品溶液的制备方法进行,平行制备供试液6份,按“2.2”项下条件测定含量,药材中金丝桃苷和芦丁的平均含量分别为0.47、0.34 mg/g。RSD分别为1.18%、1.59%。表明方法重复性较好。
2.9 回收率试验
精密称取已测知含量的百华花楸果实药材5 g,按照“2.4.2”项下样品制备方法制备供试品溶液,吸取供试品溶液2、4、6 mL各3份,分别置于10 mL容量瓶中,再精密加入高、中、低浓度的金丝桃苷和芦丁对照品溶液,加甲醇定容至刻度,按“2.2”项下色谱条件进行进样测定,结果见表6、7。结果金丝桃苷回收率的RSD与芦丁回收率的RSD均小于2%,表明该方法准确度较高。
表6 金丝桃苷回收率测定结果(n = 9)
表7 芦丁回收率测定结果(n = 9)
2.10 样品测定
取百华花楸果实药材样品6份,精密称定,置100 mL量瓶中加甲醇适量,超声提取3次,每次30 min,放冷,用甲醇稀释至刻度,摇均,过滤,取滤液再经0.45 μm的微孔滤膜滤过,即得。精密吸取供试品溶液10 μL,注入高效液相色谱仪,按“2.2”项下条件测定,记录色谱峰面积,采用标准曲线记录含量。结果样品中金丝桃苷与芦丁的平均含量分别为0.473、0.342 mg/g;RSD分别为1.29%、1.28%。结果见表8。
表8 含量测定结果(n = 6)
1.芦丁 2.金丝桃苷
图1 混合对照品(A)与样品溶液(B)高效液相色谱图
3 讨论
黑龙江省花楸属植物资源较为丰富,花楸属植物果实具有较高的药用价值,其主要的活性成分为黄酮类化合物,主要为金丝桃苷、芦丁等活性物质,具有解痉、镇咳、抗炎、抗病毒等作用。目前,对黑龙江省百华花楸果实相关研究较匮乏,尚未见有同时测定百华花楸果实中金丝桃苷、芦丁两组分的文献报道。本研究采用高效液相色谱法同时测定金丝桃苷和芦丁的含量,方法简便易行,结果准确、可靠。可作为百华花楸果实中金丝桃苷和芦丁的含量测定方法。
本实验对百华花楸果实中金丝桃苷和芦丁成分的提取条件进行了优化,分别对提取溶剂用量(10、15、20倍)、提取时间(30、50、70 min)、提取次数(1、2、3次)进行正交试验,最终确定20倍的甲醇为提取溶剂,超声提取3次,每次30 min作为最佳提取工艺,该条件下金丝桃苷和芦丁提取率较高,且方法简单,经济实用;在进行金丝桃苷色谱条件优化试验中,依据资料记载情况[16-23],分别对甲醇-磷酸;乙腈-水;乙腈-磷酸;甲醇-乙腈-磷酸等多种流动相进行了考察,结果发现以甲醇-磷酸为流动相条件下,金丝桃苷与芦丁色谱峰不能达到很好的分离,基线漂移严重;以乙腈-水为流动相条件下,金丝桃苷色谱峰存在拖尾现象;以乙腈-磷酸为流动相条件下,金丝桃苷色谱峰出现拖尾,且基线不稳;因此选择甲醇-乙腈-磷酸为流动相;考察了加入不同物质量的磷酸(0.01、0.025、0.05、0.075 mol/L)的实验结果,发现当加入0.025 mol/L的磷酸进行洗脱时的柱效和分离度最好,并能有效消除拖尾现象,因此最终确定以甲醇∶乙腈∶0.025 mol/L磷酸(10∶20∶70)为最佳流动相。
[参考文献]
[1] 国家中医药管理局.中华本草[M].上海:上海科学技术出版社,1999:2903-2906.
[2] 于明,李铣.花楸属植物化学成分、药理作用及其研究进展[J].辽宁中医学院学报,2004,6(5):364-365.
[3] 耿玮峥,吕铭洋,崔新明,等.天山花楸叶总黄酮对心肌缺血再灌注损伤大鼠心肌酶和心肌超微结构的影响[J].中国实验诊断学,2015,19(6):877-879.
[4] 李乐,仇秀红,苏向辉,等.天山花楸乙酸乙酯部位降糖效果研究[J]. 时珍国医国药,2014,25(5):1060-1061.
[5] Termentzi A,Alexiou P,Demopoulos V,et al. Inhibitory effect of Sorbus domesticca fruits extracts on aldose reductase enzyme in correlation to their phenolic content [J]. Phar Mazie,2008,63(9):8567-8569.
[6] 常军民,向阳,李毓斌,等.天山花楸药材质量标准研究[J].新疆医科大学学报,2013,36(6):785.
[7] 常军民,向阳,孟磊,等.高效液相色谱-质谱法同时测定天山花楸枝叶及果实中苦杏仁苷和金丝桃苷的含量[J].中国新药杂志,2013,22(13):1578-1586.
[8] 柴小东.百华花楸果实有效成分研究[J].辽宁林业科技,2015,(4):74-75.
[9] 长春中医学院革命委员会.吉林中草药[M].长春:吉林人民出版社,1970:114-115.
[10] 李雪梅,周雪,赵英福,等.百华花楸果实水提取液镇咳、平喘作用的实验研究[J].中国医学装备,2015,11(1):118-119.
[11] 侯甲福,李雪梅,李文超,等.百华花楸果实抗炎有效部位的研究[J].中国药物经济学,2013,9(5):225-226.
[12] 侯甲福,刘世娟,刘丹丹,等.百华花楸果实水提物的急性毒性实验研究[J].中国药物经济学,2014,9(10):221-222.
[13] 芮鸣,唐辉,王鲁石,等.天山花楸叶中总黄酮超声提取工艺研究[J].时珍国医国药,2009,20(12):3038-3040.
[14] 于晓瑾,王振宇,高宇,等.超声提取百华花楸总黄酮工艺研究[J]. 中医药信息,2015,32(5):27-31.
[15] 林錦锋,杨志业,李曼莎,等.巴戟天薄层色谱鉴别用对照提取物的研制与应用[J].中国医药导报,2015,12(27):22-25
[16] 王幻,唐辉,王国军,等.HPLC 测定天山花楸叶提取物中6 种黄酮成分[J].中国实验方剂学杂志,2014,20(15):58-61.
[17] 张薇,常军民,沈美英,等.RP-HPLC法测定天山花楸果实中苦杏仁苷、芦丁、金丝桃苷和橙皮苷的含量[J].药物分析杂志,2011,31(5):935-937.
[18] 李景庄,胡君萍,杨建华,等.HPLC-UV法测定天山花楸中金丝桃苷和芦丁的含量[J].药物分析杂志,2009, 29(2):310-312.
[19] 马晓丽,常军民,李毓斌,等.毛细管电泳法测定天山花楸中的黄酮类化合物[J].中成药,2011,33(3):534-536.
[20] 李毓斌,常军民,王岩.天山花楸药材HPLC指纹图谱的研究[J].中成药,2011,33(5):742-745.
[21] 李凤霞,王凤儒,李宏伟.高效液相色谱仪对甲硝唑注射液灭菌工艺筛选研究[J].中国医学装备,2015,1(2):37-39.
[22] 宋学英,杨华,赵逸松.高效液相色谱仪的应用分析[J].中国医学装备,2015,12(1):29-31.
[23] 王悦,童建.高效液相质谱法测定大鼠血浆中布洛芬浓度[J].中国医学装备,2014,11(B12):105.
(收稿日期:2015-11-26 本文编辑:赵鲁枫)
